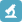经皮给药技术用于脑靶向药物递送
发布时间:2023-11-27 分享至:
中枢神经系统疾病治疗药物的脑内递送通常受到血脑屏障(blood brain barrier, BBB)的限制。经皮给药系统(transdermal
drug delivery systems,
TDDS)相较于静脉注射、口服给药和经鼻给药,具有提高患者对药物的依从性以及避免了首过效应的优势,是一种新兴的非侵入型药物的递送方式,有利于患者长期给药。淋巴通路直接从皮下靶向脑组织的途径的发现使得TDDS成为一种新型脑靶向药物递送策略。同时,纳米递药技术发展进一步促进了TDDS在脑部靶向药物递送的应用。本文综述了经皮给药入脑机制并总结了TDDS在脑部疾病治疗中的应用,为中枢神经系统疾病治疗提供了新的思路和方法。
伴随人口老龄化不断加剧,中枢神经系统相关疾病的发病率也在不断提升。据世界卫生组织统计,在全球范围内,痴呆症患病人数约5000万,其中阿尔茨海默病占痴呆症患者的60%~70%;帕金森病的患病人数超过850万,在过去25年中,帕金森病患病率增加了一倍;全球每年有500万人被确诊为癫痫,共计约有5000万癫痫患者。但是由于治疗中枢神经系统疾病的药物在递送的过程中通常会受到血脑屏障(blood brain barrier, BBB)的阻碍,超过98%的小分子药物和几乎100%的大分子药物无法有效地通过BBB,包括重组蛋白、单克隆抗体等[1, 2],导致中枢神经系统疾病的治疗并不理想。
在众多递药途径中,口服给药多存在肝脏首过效应及吸收效率低的缺陷,静脉注射存在不能长期持续给药的不足,而鼻腔给药的药物可能通过黏液纤毛清除系统从鼻腔清除[3]。经皮给药系统(transdermal drug delivery systems, TDDS)是一种非侵入型、非口服全身给药方式[4-6],不仅克服了口服给药胃肠道刺激以及首过效应的缺点[7, 8],也具有长时间持续给药的优势,并且患者依从性更好,给药方便,能够实现自我给药[9]。尽管TDDS传统上主要用于递送药物进入血液循环,经过血液循环到达治疗部位,但近年来研究发现脑膜淋巴管可连接到颈深淋巴结,因此通过颈深淋巴结给药,药物可直接流入脑膜淋巴管[10],从而用于脑部疾病的治疗。目前,TDDS用于中枢神经系统疾病的经皮治疗主要涉及帕金森病、阿尔茨海默病、抑郁症、癫痫等疾病。
因此,本文首先阐述了经皮入脑机制,其次基于纳米递药技术的发展,总结了纳米递药技术和经皮给药技术的结合应用,***后对TDDS在脑部疾病治疗中的进展进行总结(图1),以期为中枢神经系统疾病的经皮给药治疗提供思路。
1、经皮入脑机制
BBB位于中枢神经系统和毛细血管之间,是血液和脑实质之间的界面。由于BBB的复杂结构,限制了脑部药物的递送也控制了物质的进出[2, 11-13]。为了减少脑部药物递送对血液系统的依赖,研究者开发了多种绕过BBB的给药途径,包括鼻腔给药、脑组织直接给药和脑脊液给药[14]。
淋巴系统是血液循环系统的重要补充,在机体清除代谢废物、维持稳态中具有重要作用[15]。近年来有研究发现硬脑膜窦的功能性淋巴管能够将脑脊液中的内容物不断排入颈深淋巴管,即脑膜淋巴管可以连接到颈深淋巴管[16, 17]。因此,在颈深淋巴结附近给药后,药物可以通过淋巴管不断扩散至脑脊液中,进而进入脑实质,从而有效地绕过BBB[10],达到药物脑部递送的目的。
2、TDDS与纳米技术结合应用
纳米技术被广泛应用于药物的递送,可以提高药物靶向性和递送效率[18, 19]。在过去的十几年内,已有许多研究将纳米技术和经皮给药结合用以治疗皮肤病、高血压、关节炎等[20-22]。相较于其他部位药物递送,脑部药物递送通常受到BBB的限制,许多治疗脑部疾病的药物多具有亲脂性较差、半衰期较短的缺陷,很难通过BBB到达脑部且消除较快,无法达到有效浓度治疗相关疾病。因此递送该类药物时应选择合适的纳米材料,通过纳米粒、脂质体等纳米技术包载药物,提高药物的亲脂性和脑部靶向能力,使脑部的药物浓度达治疗窗。同时处方中多加入吸收促进剂,以增强皮肤的渗透性,提高药物的生物利用度。
目前,结合纳米技术和TDDS用于脑部疾病靶向治疗也有部分研究,以下将从纳米粒、纳米乳、脂质体与纳米囊泡三个方面进行总结。
2.1 TDDS与纳米粒相结合
纳米粒在近些年已被广泛应用于药物递送,具有提高疏水性药物溶解性、提高药物缓释性,增强药物渗透性和靶向性的优势[23]。聚乳酸-羟基乙酸共聚物(poly lactic-co-glycolic acid, PLGA)是一种优良药物载体,具有药物释放速率可控的特点,可以实现药物的缓释。同时,聚合物纳米粒子可以穿透BBB解决亲水性药物的递送问题。在递送司来吉兰的研究中,利用溶剂浇铸法制备乙烯-醋酸乙烯酯透皮膜,包载盐酸司来吉兰PLGA纳米粒用于经皮递送[24]。由于司来吉兰本身的亲水性很难穿透BBB到达脑部,通过PLGA纳米粒递送司来吉兰,可以穿透BBB靶向脑部,实现脑区的高药物浓度。相较于单药,纳米粒可以将药物靶向效率(drug targeting efficiency, %DTE)从117.38%±4.36%提高到136.87%±3.84%,并且经皮给药相较于静脉注射药物半衰期从0.91±3.65h增加到13.12±5.21h,具有良好的缓释作用,能够长时间维持脑部药物有效治疗浓度。
类似地,甲磺酸雷沙吉兰存在消除速率快,亲脂性较差的缺陷,Bali等[25]采用复乳溶剂挥发法制备甲磺酸雷沙吉兰PLGA纳米粒,包埋在结冷胶透皮膜内也可用于透皮递送。体内药动学研究显示,经皮递送该纳米粒药物消除半衰期为24.43±2.46h,可持续释放时间超过72h,且相较于口服给药,可以将%DTE和药物靶向潜力(drug targeting potential, %DTP)分别从107.06%±5.62%和6.60%±1.08%提高到193.75%±5.84%和48.15%±3.15%,表明PLGA具有有效递送甲磺酸雷沙吉兰靶向脑部的能力。
2.2 TDDS与纳米乳相结合
纳米乳的粒径通常在20~200nm,根据外相和内相分为双相体系(O/W或W/O)和多相体系(O/W/O或W/O/W),具有良好的亲脂性,已成为治疗阿尔茨海默病、癫痫、抑郁的药物的优良载体[26-30]。
纳米乳可用于改善亲水性药物的渗透性,增加经皮吸收的能力。Patel等[31]用含有甲磺酸雷沙吉兰的微乳凝胶透皮递送,结果显示,24h的累积渗透量可达1109.87±198.80μg⸱cm-2,远高于普通水凝胶累积渗透量672.56±49.44μg⸱cm-2。
同时,纳米乳还具有增强生物利用度的特点。用纳米乳凝胶经皮递送罗匹尼罗的研究显示生物利用度相较于普通片剂提高了2.26倍,与普通凝胶剂相比提高了7.69倍[32]。以水包油(O/W)微乳为贮库,乙烯-醋酸乙烯酯膜为释放衬垫递送2, 3, 5, 6-四甲基吡嗪的研究中[33],基于微乳的TDDS皮肤渗透量是普通透皮贴剂的8.2~26.7倍,且相对生物利用度可达350.89%。
2.3 TDDS与脂质体和纳米囊泡相结合
脂质体是一种由脂质制备的具有双层磷脂层结构的纳米载体,可以同时包载亲水性和亲脂性的药物[34, 35]。作为经皮给药的载体,其可以有效提高亲水性药物在皮肤中的分布,促进药物的皮肤吸收,增加皮肤渗透性,也具有一定的缓释作用。包载利斯的明的脂质体经皮递送后[36],52%的药物在24h后缓慢释放,而水对照组中利斯的明100%在2h后释放,该脂质体在48h内皮肤透过量可达91.5%±3.37%,24h内血药浓度-时间曲线下面积(area under carve, AUC)为3605±244.4h⸱ng⸱mL-1,相较于水对照组的1710.6±177.2h⸱ng⸱mL-1明显提高。
Liu等[37]对姜黄素脂质体和同源小鼠自然杀伤细胞来源的自然杀伤细胞片段混合物反复冻融制备成一种自然杀伤细胞膜仿生纳米脂质体,通过颈部皮下注射经淋巴通路入脑。与单纯姜黄素脂质体对比,释放速率降低为原来的约1/2,表明其具有良好的缓释效果,可以长时间维持有效治疗浓度。
囊泡在结构上与脂质体类似,也具有两亲性,同样可用于经皮给药[38, 39]。利用萜类化合物本身具有的亲脂性包封药物可以提高药物的包封率,同时克服角质层细胞的紧密堆积,从而增强亲脂性分子的皮肤渗透性。El-Tokhy等[40]利用薄膜水化技术制备了萜类化合物的包合物纳米囊泡递送马来酸阿塞那平,研究显示经皮给药后,阿塞那平达峰浓度(Cmax)为9.5±1.2μg⸱mL-1,同时具有缓慢释药的能力,在72h内持续释药,AUC0-72h达390.0±18.5h⸱ng⸱mL-1,均远高于口服途径。此外,囊泡还可以提高药物的生物利用度,同时延长药物作用时间。Tawfik等[41]实验制备了羟丙基甲基纤维素K4m(hydroxypropyl methylcellulose K4m, HPMC)凝胶用于经皮递送包载阿戈美拉汀的纳米囊泡。体内药动学实验结果显示阿戈美拉汀AUC0-12h和AUC0-∞分别为421.89±79.40和430.21±84.31 h⸱ng⸱mL-1,达峰时间(tmax)为1h,显著高于口服给药。
3、TDDS在疾病治疗中的应用
基于经皮给药具有非侵入性的优势且有望靶向脑部的特点,因此在脑部疾病的治疗中应用广泛。淋巴通路靶向脑部组织使得药物对于脑组织外器官组织的损害程度降低,具有更低的毒性,从而提高药物的生物相容性。同时,皮肤作为经皮给药的重要屏障,常用微针、微乳等方式提高药物穿透皮肤的能力,增加药物的生物利用度。以下分别总结TDDS在帕金森病、阿尔茨海默病、抑郁症和癫痫中的应用。
3.1 帕金森病
帕金森病是一种兼具运动和非运动特征的神经退行性疾病,多巴胺能神经元的丢失和多巴胺水平的降低是主要的病理特征[42],在药物治疗中,多巴胺激动剂和单胺氧化酶B抑制剂是治疗帕金森病的有效药物[43]。
如前文所述,药物可以在颈深淋巴结附近给药后,通过淋巴管不断扩散至脑脊液中,进而进入脑实质。相对于普通透皮治疗,通过淋巴通路经皮递送药物治疗帕金森病,不仅提高了药物的脑靶向能力,同时也提高了药物递送的效率,可显著改善帕金森病的症状。
由于左旋多巴结构中含有丰富的氢键给体和受体,使用含有丰富羟基的载体可以提高药物的负载能力。Nie等[44]用单宁酸作为交联剂,利用快速纳米复合技术与含有丰富羟基的聚乙烯醇制备成纳米粒负载左旋多巴用以颈部皮下注射。毒性实验显示该纳米粒具有良好生物相容性,对模型大鼠进行运动障碍的转棒实验显示纳米粒经颈部皮下注射后,利血平诱导的帕金森大鼠能够承受的***高转速较静脉给药提高60%。同时评价该纳米粒对氧化应激和纹状体功能障碍的治疗作用的结果显示,颈部皮下注射给药使得该纳米粒在脑中生物分布较模型组提高30%,由于脑内较高的单宁酸浓度,缓解了疾病引起的氧化应激,并且纹状体中酪氨酸羟化酶表达与正常健康大鼠水平相当,表明纹状体功能也明显改善。
近期,Liu等[37]将姜黄素脂质体和同源小鼠细胞来源的自然杀伤细胞膜片段的混合物反复冻融,制备成一种自然杀伤细胞膜仿生纳米复合物用以颈部皮下注射,也证明了淋巴通路作为一种靶向脑组织的新通路对脑部疾病具有治疗效果。该脂质体除了具有良好的缓释效果外,在转棒实验中皮下注射该脂质体的帕金森小鼠保持时间为130s,相较于静脉注射该脂质体延长了35s,并且组织学分析显示,皮下注射该脂质体小鼠黑质中存活的多巴胺神经元显著增多。
3.2 阿尔茨海默病
阿尔茨海默病是一种进行性神经退行性疾病,淀粉样蛋白β(amyloid, Aβ)肽的异常纤维沉积和tau蛋白的神经纤维缠结是典型组织病理学特征[45, 46],胆碱酶抑制剂如多奈哌齐、利斯的明、加兰他敏多用于阿尔茨海默病的治疗。
为了改善亲水性药物皮肤渗透能力差的不足,部分研究通过将药物包载在微针中增强皮肤渗透性。Kim等[47]采用基于HPMC-乙醇/水混合物和羧甲基纤维素水的微模塑方法制备包含盐酸多奈哌齐的微针,经小鼠背部皮肤给药。药动学研究显示,相较于口服给药,在给药剂量为692μg⸱kg-1时,微针生物利用度是口服给药的2.4倍,相同剂量微针给药的Cmax是口服给药的4倍。类似地,Zhao等[48]制备了以甲基丙烯酰明胶为基质的微针用于皮下植入递送盐酸多奈哌齐,在微针皮下刺破后,背衬层的聚乙烯醇溶解进而包裹针体实现药物的控释。对小鼠给药后血浆和脑组织利用酶联免疫吸附实验进行检测,结果显示微针给药相对于口服给药乙酰胆碱浓度升高更明显,同时Aβ1-42浓度降幅更大。
然而,2019年有研究发现长期服用非甾体抗炎药也可以预防阿尔茨海默病[49],但由于非甾体抗炎药只有1%~2%到达大脑,因此不具有治疗效果。但该研究提出由于理论上双氯芬酸具有中等疏水性,因此通过在颈后或颈椎经皮给药,应容易穿透硬脑膜进入脑脊液到达大脑,从而治疗阿尔茨海默病。但仍未有相关实验数据证明该方法可以有效治疗阿尔茨海默病。
3.3 抑郁症
抑郁症是一种常见且易复发的精神疾病,谷氨酸增加和γ-氨基丁酸减少是抑郁症的主要表现[50],单胺氧化酶抑制剂是治疗抑郁症的主要药物[51]。
用于治疗抑郁症的传统透皮贴片为司来吉兰贴片,司来吉兰贴片由司来吉兰和丙烯酸压敏胶混合作为载药层,氮酮为吸收促进剂,铺于镀铝聚酯膜背衬层上,表面覆盖贴剂防粘保护层得到[52]。有研究发现在6例中重度抑郁症患者中给予静脉注射氯胺酮联合司来吉兰贴剂的治疗中,患者情绪明显改善,自杀行为减少,食物摄入量也显著增加[53]。
进一步研究发现,艾司氯胺酮作为氯胺酮的右旋异构体,也具有快速抗抑郁的作用,同时水凝胶微针能够经皮递送小分子药物。Courtenay等[54]构建了水凝胶微针用以艾司氯胺酮的经皮递送。实验证明微针可以为大鼠持续释放艾司氯胺酮超过24h,且24h内血药浓度>0.15~0.3μg⸱mL-1。另外,Kumar等[55]制备了度洛西汀与磺丁基醚-β-环糊精复合的透皮贴剂,对大鼠经皮递送度洛西汀与磺丁基醚-β-环糊精复合物透皮贴剂后,采用数字式光电测速仪对大鼠的自主活动进行测试,结果显示两药联合经皮组大鼠行走和直立次数远高于单纯度洛西汀透皮给药组和灌胃给药组,具有较好的抗抑郁作用。
3.4 癫痫
癫痫是一种严重的神经系统疾病,由于大脑中神经元异常放电,导致癫痫反复发作[56]。目前抗癫痫药物仅用于控制癫痫发作,缺乏预防和治疗手段[57]。
经皮递送药物中皮肤是重要的屏障,只有少数药物可以透过,利用微乳包载药物可以有效地促进角质层的水合作用,增加药物透过皮肤的能力。Figueiredo等[58]通过匹罗卡品诱导大鼠癫痫发作,制备苯巴比妥经皮微乳治疗,结果显示以40mg⸱kg-1剂量经皮给药后,苯巴比妥微乳50mg⸱g-1组和100mg⸱g-1组均有80%的存活率,癫痫危象分别减少了26.7%和13.4%,同时谷胱甘肽水平分别升高了51.1%和51.7%,对癫痫有治疗效果。
已有药物的临床试验中显示出经皮给药具有改善癫痫症状的积极效果。在一位癫痫性脑病患者的治疗中,通过从7mg至21mg尼古丁贴剂透皮给药[59],在给药一个月后,该患者癫痫次数明显减少,1个月后完全停止,并且脑电图在7年以来***正常化,在认知、情感等方面均有一定改善。另外,有研究评价了每日2次应用大麻二酚透皮凝胶,剂量为125~500mg对儿童发育性和癫痫性脑病中的作用[60]。结果表明在6.5个月后,患者癫痫发作频率减少中位数为12.3%,患者生活质量提高。
3.5 其他脑部疾病
TDDS还应用在其他脑部疾病中,如脑损伤。药物包载在可溶微乳中,与组织液接触时迅速溶解,药物能够从微乳中迅速释放。Zhang等[61]以聚乙烯吡咯烷酮为基质制备了桂利嗪微乳,利用溶解微针通过颈部经皮递送,用以治疗微波引起的脑损伤。通过水迷宫空间探索实验,大鼠在基于桂利嗪微针后第3天和第5天平均逃避潜伏期值相较于未接受治疗的大鼠显著降低。同时相较于未接受治疗大鼠,旷场实验检测给药后大鼠在中央区总路程、中心路程和进入次数均显著增加[61]。实验显示与模型组相比,桂利嗪微针给药大鼠锥体细胞层神经元排列整齐、致密,无核固缩,表明脑损伤受损情况有所改善。
4、结论和未来展望
TDDS作为一种新型的非侵入型给药方式,结合持续发展的纳米递药技术,近些年被用于脑部靶向药物递送,从而治疗包括帕金森病、阿尔茨海默病、抑郁症、癫痫、脑损伤等在内的脑部疾病。
TDDS具有延长药物作用时间,提高患者依从性等优势,患者服药更加便利,耐受性也较为良好。但是,部分实验显示透皮贴剂存在少量瘙痒、过敏、接触皮炎等皮肤问题,部分贴剂还存在嗜睡、头痛等不良反应,多为轻度到中度,需要及时停药才可得到改善,对药物的持续释放造成阻碍。
2020年发现了脑膜淋巴管和颈深淋巴结的连接,揭示了一条淋巴通路用以药物脑靶向递送,通过直接递送药物进入脑部从而减少BBB对脑部药物递送的阻碍。淋巴通路脑靶向给药具有可绕过BBB的优势,同时可以减少药物对身体其他部位的不良反应。目前,关于淋巴通路递送脑部疾病药物的研究并不充分,文中总结的经皮淋巴通路靶向递送药物针对治疗帕金森病,而治疗其他脑部疾病的递药方式还未拓展至经皮淋巴通路,多是通过经皮给药首先进入血液循环,后递送进入脑部的研究,淋巴通路作为一种药物脑靶向的新途径,有望成为未来脑靶向给药的一个有价值的研究方向,具有一定研究意义。
免责声明:本文为行业交流学习,版权归原作者所有,如有侵权,可联系删除