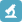量子点偶联免疫脂质体构成多功能肿瘤靶向药物载体
发布时间:2024-01-02 分享至:
脂质体可用作人体药物递送载体,而免疫脂质体(Immunoliposomes, ILs)是将抗体片段偶联于载药脂质体,借助抗体与靶细胞表面抗原或受体的结合,经过接触释放、吸附、吞噬、吞饮及融合等方式,释放出包封的药物,特异性杀伤靶细胞,从而完成靶向药物递送和特异性治疗。针对HER2和EGFR的免疫脂质体,可将抗癌药物靶向递送入肿瘤细胞,目前已用于临床肿瘤治疗的测试。在免疫脂质体载药体系研发过程中,需要在细胞和亚细胞水平对脂质体进行示踪,监控其与肿瘤细胞的时间及空间作用特性。量子点(Quantum dots, QDs)作为纳米荧光探针,具有超高亮度和***的光稳定性,成为研发可光学示踪的多功能载药体系的优质选择。
加州大学John W. Park课题组,将HER2抗体scFv片段连接于脂质体,同时偶联量子点,获得可示踪的、负载抗肿瘤药物(Doxorubicin)的免疫脂质体(QD-conjugated immunoliposome -based nanoparticles, QD-ILs)(图1)。在体外细胞学实验中,通过激光共聚焦显微镜和流式细胞仪的观察与分析,上述量子点标记的免疫脂质体被HER2高表达的乳腺癌细胞高效摄取,每个HER2阳性细胞通过免疫脂质体摄取的量子点数目达到~2.2×106,同时没有发现细胞毒性。裸鼠在体实验中,免疫脂质体使量子点在血液循环中的停留时间显著延长,血浆终末半衰期为2.9h,而游离量子点的半衰期小于10min。以HER2过表达细胞MCF-7/HER2构建乳腺癌动物模型,通过尾静脉注射量子点标记的免疫脂质体,在体荧光成像显示,QD-ILs定位于肿瘤部位,具有显著的抗肿瘤活性(图2);同时进行了3个月的毒性实验,裸鼠没有出现体重丢失和其它显著毒性。总之,量子点与免疫脂质体联合应用于载药体系,对于体外及体内靶向药物研究提供了新颖而直观的研究手段。
图1量子点标记的免疫脂质体载药系统(QD-ILs)模式图
图2量子点标记的免疫脂质体载药系统的在体荧光成像
文献来源:
Weng KC, Noble CO, Papahadjopoulos-Sternberg B, Chen FF, Drummond DC, Kirpotin DB, Wang D, Hom YK, Hann B, Park JW. Targeted tumor cell internalization and imaging of multifunctional quantum dot-conjugated immunoliposome in vitro and in vivo. Nano Lett. 2008;8(9):2851-7.
根据不同科研客户需求,提供定制不同种类的近红外二区量子点,可以定制调节波长、尺寸等参数。
近红外二区油溶性/水溶性PbSCdSe量子点 偶联抗体/药物/氨基酸/多肽/蛋白质/PEG衍生物/咪唑修饰的石墨烯量子点/氨基-甲酰基咪唑修饰还原石墨烯等
近红外二区油溶性/水溶性ZnCdSe/ZnS量子点偶联抗体/药物/氨基酸/多肽/蛋白质/PEG衍生物/咪唑修饰的石墨烯量子点/氨基-甲酰基咪唑修饰还原石墨烯等
近红外二区油溶性/水溶性硒化银Ag2Se量子点偶联抗体/药物/氨基酸/多肽/蛋白质/PEG衍生物/咪唑修饰的石墨烯量子点/氨基-甲酰基咪唑修饰还原石墨烯等
近红外二区油溶性/水溶性ZnCdSe/ZnS量子点偶联抗体/药物/氨基酸/多肽/蛋白质/PEG衍生物/糖类小分子/咪唑修饰的石墨烯量子点/氨基-甲酰基咪唑修饰还原石墨烯等
近红外二区油溶性/水溶性PbS硫化铅量子点 偶联抗体/药物/氨基酸/多肽/蛋白质/PEG衍生物/咪唑修饰的石墨烯量子点/氨基-甲酰基咪唑修饰还原石墨烯等
近红外二区油溶性/水溶性Ag2Te碲化银量子点 偶联抗体/药物/氨基酸/多肽/蛋白质/PEG衍生物/咪唑修饰的石墨烯量子点/氨基-甲酰基咪唑修饰还原石墨烯等
可以提供多种不同核壳型不同尺寸的荧光量子点:
CdSe/ZnS硒化镉-硫化锌量子点 ,CdS/ZnS硫化镉-硫化锌荧光量子点,InP/ZnS磷化铟-硫化锌荧光量子点,ZnSe/ZnS硒化锌-硫化锌荧光量子点,ZnCdSe/ZnS荧光量子点,PbS量子点,CQDs量子点,Ag2Te量子点,Ag2Se量子点,Ag2S量子点,WS2量子点,MoS2量子点,Perovskite QDs(钙钛矿量子点)等等。根据实际需要,接受定制各种波长和尺寸的量子点(包括远红外二区量子点),还可以定制掺杂。